瑞德西韦中国两项临床试验已停止,最新进展情况如何?
瑞德西韦中国两项临床试验已停止
接下来具体说说最新进展情况如何
瑞德西韦在中国的两项临床试验终止!
编审专家:
张镭 中日友好医院 药剂科 副主任药师
2020年4月15日吉利德科学公司发布了在中国湖北省武汉市开展的瑞德西韦两项临床试验的最新状态。
瑞德西韦治疗新型冠状病毒肺炎 重症患者的临床试验已终止 ,因为中国目前已很好地控制了疫情,无符合要求的合格患者入组。此前已入组237例患者。
瑞德西韦治疗新型冠状病毒肺炎 轻至中度患者的临床试验已暂停 ,同样是因为无法招募到合格患者。此前已入组308例患者。
这两项临床试验从2020年2月5日宣布启动就吸引了大众目光,试验结果被寄予厚望,为什么这两项试验又被终止了呢?
首先,我们要明确一点,这两项试验为随机、双盲、安慰剂对照的临床Ⅲ期试验。一般来说, Ⅲ期临床试验需要在较大范围的患病人群中进行,需要几百至上千人 ,在多元化人群中获取临床相关数据,全面评估风险,更广泛地考察新药对人体的安全性、有效性以及使用过程中合并用药等问题。
尽管这两项临床试验的入组人数比正常Ⅲ期临床试验要求人数少得多,但仍因为“入组率低”而取消,这是为什么呢?
靠前,**通过封城、限制出行等强有力措施,使得新型冠状病毒肺炎疫情得到快速、有效的控制,患病人数迅速减少,因而使得符合入组的患者减少。
第二,中国国内有大量与新型冠状病毒肺炎相关的临床试验同时开展,各试验组竞争有限的患者入组,导致参加这两项瑞德西韦临床试验的患者病例数不足。
第三,临床试验入组条件的限制。以此次瑞德西韦临床Ⅲ期试验为例,治疗新型冠状病毒肺炎重症患者的临床试验,其中一条入组标准要求患者发病时间≤12天,治疗新型冠状病毒肺炎轻至中度患者的临床试验要求患者发病时间≤8天,还需排除严重肝肾功能不全者,并排除30天内服用过其他新型冠状病毒肺炎试验药物的患者。这些严格的入组标准就会筛掉很多患者,使其无法参与临床试验。
由于以上因素,造成了这两项临床试验入组人数不足的状况,为保证临床试验最终结果的科学性与准确性,试验不得不终止。
虽然这两项临床试验已被终止或暂停,但在已入组患者上取得的试验数据仍具有价值。重症患者的研究数据预计四月底公布,轻至中度患者的研究数据公布时间待定。所以关于瑞德西韦的有效性,我们目前并不能妄下结论。
此前,2020年4月10日吉利德科学公司就在《新英格兰医学杂志》发布了53名患者在同情用药项目中接受在研抗病毒药物瑞德西韦治疗的数据。这一有限的数据结果显示,接受用药的患者总病死率为13%,瑞德西韦为68%的患者带来临床改善。
根据吉利德科学公司官网消息,除了在中国湖北武汉开展的两项瑞德西韦临床试验,目前还有其他五项临床试验已经启动,以确定瑞德西韦治疗新型冠状病毒肺炎的安全性和有效性。
其中包括吉利德科学公司作为申办方,在美国、亚洲和欧洲的新型冠状病毒肺炎高发地区进行的两项三期研究。其中一项研究针对重症患者,另一项研究针对中度患者。这些研究要回答的众多问题之一是,治疗时间是否可以从10天缩短到5天。重症的入组患者人数已达到了最初设计要求的人数,吉利德科学公司现在已经扩大了研究范围,让包括接受机械通气的患者在内的更多患者可以参与其中。

美国国家过敏和传染病研究所(National Institute of Allergy and Infectious Diseases,NIAID)于2020年2月21日开始了一项全球试验。该试验将随机分配患者使用瑞德西韦或安慰剂,以对照比较试验结果。该试验正在入组约800名具有不同症状的患者。
世界卫生组织也在进行一项全球试验,名为“团结”的临床试验最近也已在欧洲开始。
尽管在中国的临床试验因“入组人数不足”终止了,但就目前全球新冠药物研发来看,瑞德西韦仍是为数不多的几种被寄予希望的药物。我们期待在海外的临床试验中有更多的临床数据公布出来。
参考文献
[1] Grein J, Ohmagari N, Shin D, Diaz G, Asperges E, Castagna A, Feldt T, Green G, Green ML, Lescure FX, Nicastri E. Compassionate Use of Remdesivir for Patients with Severe Covid-19. New England Journal of Medicine. 2020 Apr 10.
瑞德西韦在华临床试验被迫终止,专家呼吁建立*家级临床试验网络
瑞德西韦临床试验在中国遇挫。美国临床试验注册网站信息显示,4 月 15 日,中国的 2 项瑞德西韦临床研究已经终止。究其原因,除了该研究入组门槛高,更主要的原因是国内上马的新冠临床试验太多,抢走了患者资源。
这是一个令人遗憾的消息。诸多舆论称,瑞德西韦试验是被众多上马的临床试验 “淹死” 的,瑞德西韦失去了在尽早严谨证明其新冠疗效和安全性的良机,让该药的新冠治疗无法获得国内更高质量的循证医学证据。
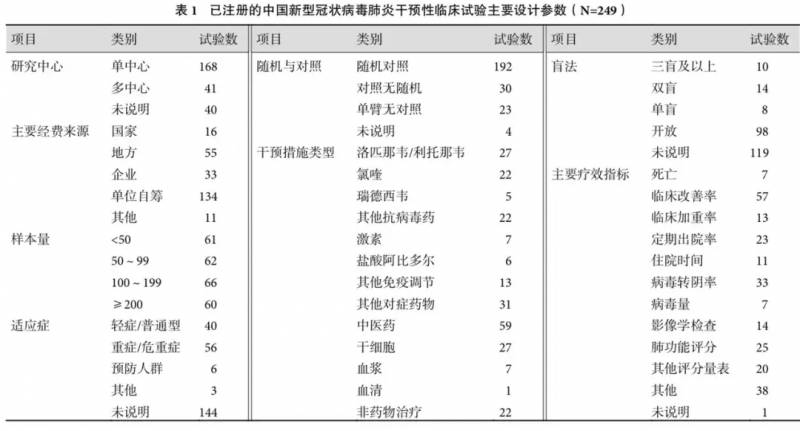
美国南卡罗来纳医科大学公共卫生系教授赵文乐和北京大学靠前医院医学统计室主任姚晨注意到了此问题。他们分析了 2020 年 1 月 23 日至 3 月 5 日期间的 249 个中国境内的干预性新冠临床研究,这些研究注册在中国临床试验注册中心和美国临床试验注册网站两个平台上。
疫情期间各个临床试验项目在国家层面缺乏统筹协调,其中最为突出的风险是研究重复、设计不合理、运作低质量以及研究无法按时完成。赵文乐和姚晨呼吁,应该终结大量临床试验开展的无序状态,建议通过构建覆盖全国的国家临床试验网络,提高临床试验的设计质量与运作效率。
这个建议发表在 3 月 31 日的《中国循证医学杂志》,题为《新型冠状病毒肺炎(COVID-19)临床研究的启示与国家临床试验网络构想》。姚晨告诉 DeepTech,此方案既可以解决研究数据透明化,也能提高试验设计质量。
无序研究挤兑患者资源
首当其冲的问题是重复研究。在这 249 个临床试验中,有 27 个涉及洛匹那韦 / 利托那韦;有 22 个涉及氯喹类药物,包括氯喹、羟氯喹、磷酸氯喹或硫酸羟氯喹;有 6 个涉及盐酸阿比多尔。在 59 项包含中医中药治疗方案的临床试验项目中,10 个涉及具体中成药,其余 49 个则是中医辩证治疗或中西医结合治疗。
众多研究项目蜂拥而上,显然会导致各个项目样本量受限,而样本量是影响临床试验结果准确性和可信度的主要因素。在 249 个项目中,约一半试验的样本量不足 100 例,而 249 个临床试验项目的样本量合计超过了当时中国全部确诊病例数的三分之一。作者认为,小样本量项目不仅难以取得可靠的结论,而且客观上会导致患者资源挤兑,对大型多中心临床试验项目的完成构成威胁。
具体到这些临床试验的统计学设计,有 192 个为随机对照试验,其中 32 个表明采取盲法设计,如瑞德西韦临床试验方案中明确采用了严格的随机双盲安慰剂对照试验设计。其余 217 个均为开放性试验或未说明是否采用盲法。
作者指出,一个治疗方案的安全性和有效性需要通过与另一个方案(包括安慰剂)比较而得出。如果没有设立对照组,即使在一个药物治疗之后有 80% 患者康复,也不能说明该药物有效。因为这些患者可能还有其它措施介入治疗,设立对照组的主要目的,就是为了控制其它干预措施的影响。
此外,即使在有对照的临床试验中,如果没有盲法措施的配合,患者招募与分组、治疗实施、数据评价等环节都可能受到研究人员个人意志的影响,从而给研究结果带来选择性偏倚。
临床研究的客观结论有时候是残酷的,有些候选药物或疗法可能是无效的,这并不符合人们的期望。姚晨说,有的临床研究人员为了追求发表阳性结果,可能会“报喜不报忧”,然而药物的研发是要有时间的,人们对新冠病毒疾病的认识也是逐步深入的。
(来源:中国循证医学杂志)
姚晨说,临床试验研究的设计需要统计学家参与,因为很多临床研究者虽然对统计分析有所了解,但并不完全掌握随机分组、对照设计和统计分析等方法。另外,为保证随机分组的均衡性,效应指标评价的公正性,这些都需要对参与试验的临床医生设盲,以尽可能减少受试者的选择性偏倚和评价过程中的信息偏倚。
据靠前财经报道,中国瑞德西韦临床试验项目负责人、中日友好医院副院长曹彬教授认为,随机双盲对照试验(RCT)是非常严格的临床试验,要验证药物的有效性,就必须要有安慰剂组的对照。如果让他重新设计瑞德西韦的临床试验方案,仍然会遵从当时设计的对照组的思路。他强调说,只有安慰剂对照,才能有效地避免研究者的主观性;如果不设盲,就容易误把病人的疗效归功于研究成果,把病人的恶化归咎于疾病的进展。
美国临床试验网络的参照
美国的国家临床试验网络作法可为参照。在美国,相对于由单个研究机构*组织临床试验项目,国家临床试验网络在质量与效率方面已经展示了优势。
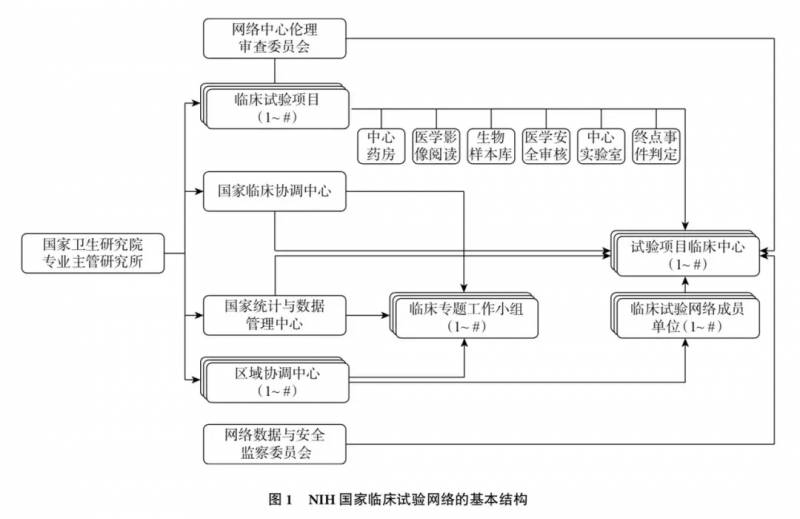
赵文乐告诉 DeepTech,美国国家临床试验网络的核心是国家临床协调中心和国家统计与数据管理中心。两者相对*,前者负责试验项目的临床医学设计,后者负责试验项目的统计学设计与数据分析。
美国国立卫生研究院(NIH)已经在多个疾病领域组建了覆盖全国的临床试验网络,如国家癌症研究所组建的国家临床试验网络,国家神经系统疾病与脑卒中研究所组建的国家卫生研究院卒中临床试验网络,国家过敏与传染病研究所组建的艾滋病预防临床试验网络等。
这些网络基础设施均包括 1 个国家临床协调中心(NCCC),1 个国家统计与数据管理中心(NSDMC)和若干区域协调中心。各中心通过公开项目招标,经同行专家评审小组评审,由 NIH 专业主管研究所常设顾问委员会审议批准资助。国家临床试验网络基础设施要素通常每隔五年进行一次更新审议,会进行再次公开招标。
从 2018 年起,NIH 还要求所有受其资助的多中心临床试验采用中心伦理审查机制。
(来源:中国循证医学杂志)
作为临床试验资助方,NIH 为各临床试验网络分别组建*的数据与安全监察委员会,负责对网络内所有临床试验项目的安全性数据、有效性数据、整体研究进度和数据质量进行定期和不定期审查,并就临床试验项目是否需要终止或按计划继续进行,向资助方和项目承担者提出建议。其成员由临床试验网络资助方 NIH 专业主管研究所指定,包括相关领域临床医学、生物统计学和临床伦理学等方面的专家。
赵文乐说,这种覆盖全国、且在具体疾病领域内唯一的临床试验网络,在临床试验项目的开发过程中对全国各地的研究人员开放。换句话说,非成员单位的研究人员同样可以与国家临床试验网络合作,向 NIH 提交具体的临床试验项目申请。一旦通过同行评审并获资助,该项目将由国家临床试验网络负责实施。
目前 NIH 下属的国家过敏与传染病研究所资助了瑞德西韦对新冠病毒患者治疗的随机、对照、双盲三期临床试验。该项目于今年 2 月启动,计划从 75 个试验中心,包括若干亚洲与欧洲的试验中心,入组 400 名患者。
中国可行性需要探讨
两位作者认为,新冠疫情期间大量临床试验开展的无序状态反映了组建覆盖全国的国家临床试验网络的必要性,后者可以集中人才、资金、技术和患者资源,通过统筹规划,设计运作高质量大规模临床试验,可以在短期内寻找安全有效的治疗方案。
自 2012 年起,中国科技部在 20 个疾病领域陆续组建了 50 个国家临床医学研究中心,其中包括 3 个国家呼吸系统疾病临床医学研究中心。两位作者认为,可以考虑在现有国家临床医学研究中心基础上,构建国家呼吸系统疾病临床试验网络,并通过公开招标、同行专家评审,选定一个研究型大学或医院作为该网络的统计与数据管理中心。
同时,在国家网络内先行探索并采用中心伦理审核机制,负责对网络内新注册的临床试验项目进行伦理审核。这种模式还可以在此次疫情结束后逐步推广至其他疾病治疗领域。
赵文乐告诉 DeepTech,中国开展临床试验有许多得天独厚的有利条件,临床医学水平高,统计学人才充裕,患者资源丰富,信息技术软硬件条件更是领先于大部分国家,但“我们需要的是新的理念”。
赵文乐表示,大型多中心临床试验需要合作,不需要竞争。建立覆盖全国的专业临床试验网络,可以集中各地的人才资源,设计并运作高质量的临床试验项目。成员单位可以依托国家网络,参与大型临床试验项目,而无需各自孤军奋战,更可以防止互设壁垒。
姚晨的看法是,考虑中国的现实, 首先要考虑解决临床研究源数据的所有权问题,这些临床源数据大多是医院的医疗行为产生的,所有权归医院。只要做到去隐私,临床研究数据是可以共享的。
姚晨等人此前多次探讨此问题,他们认为其中一个很关键的问题是要有一个医院临床源数据通用管理流程,建立各专业专病数据库,实现电子化源数据的后结构化,需要按照透明化理念,去产生高质量的、可溯源的、标准相同的研究数据。目前国内医疗系统的一些重要的临床试验项目依旧使用纸质病例报告表采集数据,即使采用了电子病例报告表,依然在由研究者人工输入数据。
曾长期担任美国 FDA 新药审评员的思路迪医药首席执行官龚兆龙也看好此建议,他告诉 DeepTech,建立国家临床试验网络是一个非常好的建议,也很适合新冠疫情这样的公共卫生危机来采纳。如果有这样的国家网络,用统一标准的临床研究数据说话,可以高效利用有限的临床资源,在尽可能短的时间内看到结果,“大家也服气”。
龚兆龙说,在重大传染病面前,如果有这样的国家网络,可以很快找到真正安全有效的治疗手段,为国家决策提供科学依据。
上海市(复旦大学附属)公共卫生临床中心药物临床试验机构办公室主任马媛媛则担心,临床试验需要责任主体,伦理委员会也需要承担相应责任,即出了问题谁来负责就可能是上述试验网络的掣肘。
马媛媛说,还有一个问题就是,当数家机构同时申请一个项目,研究实力和试验设计又接近的时候,“为什么只能批一个呢”?另一种情况则是,如果是谁先申请就批给谁,大家就会抢着去申请,又难以保证试验设计的严谨性和可行性,也难以保证审批的公平性。
以上就是瑞德西韦中国两项临床试验已停止,最新进展情况如何?的详细内容,希望通过阅读小编的文章之后能够有所收获!
